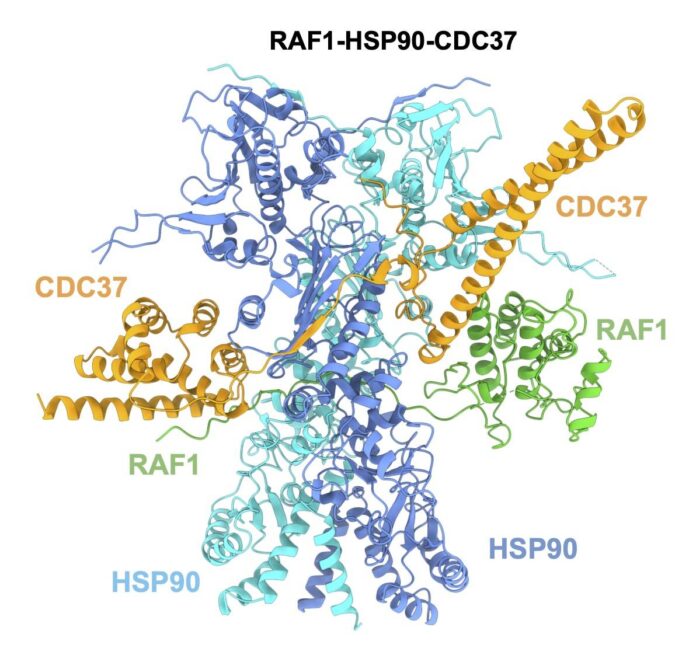
Un equipo científico español ha conseguido determinar la estructura de la proteína RAF1, una diana terapéutica contra los tumores asociados a oncogenes KRAS, responsables de la cuarta parte de todos los tumores humanos, incluyendo el adenocarcinoma de pulmón.
Los grupos de Mariano Barbacid en el Centro Nacional de Investigaciones Oncológicas (CNIO), y Guillermo Montoya, de la Universidad de Copenhague, han conseguido determinar la estructura de la proteína RAF1, una diana terapéutica contra los tumores asociados a oncogenes KRAS.
Este resultado, que se publica en Molecular Cell, permite identificar vulnerabilidades estructurales en RAF1, lo que hace posible el diseño de fármacos capaces de destruirla.
El resultado permite identificar vulnerabilidades estructurales en RAF1, lo que hace posible el diseño de fármacos capaces de destruirla
“La generación de degradadores de RAF1 representa una opción realista para llevar a la práctica clínica estos resultados experimentales, y poder así combatir estos tumores con nuevas armas terapéuticas en un futuro no demasiado lejano”, afirma Sara García-Alonso, investigadora del CNIO y coautora principal del trabajo
El desarrollo de fármacos contra los oncogenes KRAS es uno de los principales retos en oncología. Estos oncogenes —genes que cuando adquieren una mutación provocan cáncer— son responsables de la cuarta parte de todos los tumores humanos, incluyendo los tres tipos tumorales con mayor mortalidad: el adenocarcinoma de pulmón, el carcinoma colorrectal y el adenocarcinoma ductal de páncreas.
A pesar de que los oncogenes KRAS fueron descubiertos por el grupo de Mariano Barbacid hace ya cuatro décadas, el primer fármaco contra ellos —Sotorasib, Amgen— solo ha sido aprobado en EEUU hace poco más de un año. Pese a la importancia de este hito, el impacto clínico de Sotorasib es limitado, pues solo actúa contra tumores portadores de una de las múltiples mutaciones presentes en los oncogenes KRAS. Además, los pacientes tratados con este fármaco desarrollan resistencias a los pocos meses de tratamiento.
Más allá del desarrollo de fármacos contra KRAS, una de las áreas de investigación más activas en este momento consiste en identificar inhibidores de proteínas, como RAF1, responsables de transmitir las señales oncogénicas de KRAS.
En este sentido, el laboratorio de Barbacid, utilizando modelos de ratón genéticamente modificados que reproducen fielmente los adenocarcinomas de pulmón humanos, demostró hace cuatro años que la eliminación de la proteína RAF1 inducía la regresión de la mayoría de los tumores sin causar toxicidades significativas.
Objetivo: degradar la proteína RAF1
Estas observaciones han generado un enorme interés en conseguir fármacos capaces de degradar RAF1. Los resultados publicados Molecular Cell abren una vía para diseñar degradadores de RAF1 que, bien por sí solos o en combinación con inhibidores de KRAS, puedan generar un importante efecto terapéutico en pacientes con adenocarcinoma de pulmón inducido por oncogenes KRAS.
La determinación de la estructura 3D de RAF1 es un paso clave porque pone al descubierto las partes de la proteína a las que un fármaco podría anclarse químicamente, y promover su destrucción
La determinación de la estructura tridimensional de RAF1 es un paso clave en ese objetivo porque pone al descubierto las partes de la proteína a las que un fármaco podría anclarse químicamente, y promover su destrucción por parte de la maquinaria celular (la célula tiene mecanismos de limpieza que se ocupan de degradar las proteínas que considera defectuosas o inútiles).
Los principales investigadores responsables de este trabajo han sido Sara García-Alonso, del CNIO, y Pablo Mesa, del grupo de Biología Molecular y Estructural de la Universidad de Copenhague.
“La información que proporciona este estudio abre un abanico de opciones para desarrollar fármacos que consigan degradar RAF1”, señala García-Alonso.
Financiación
El grupo de Barbacid ha sido financiado principalmente por la Fundación CRIS contra el Cáncer, la Asociación Española Contra el Cáncer y el AXA Research Fund, así como por fondos públicos del Ministerio de Ciencia e innovación y del Consejo Europeo de Investigación (ERC, siglas en inglés).
Referencia:
Sara García-Alonso, Pablo Mesa et al “Structure of the RAF1-HSP90-CDC37 complex reveals the basis of RAF1 regulation” Molecular Cell (2022).
Fuente: CNIO
Derechos: Creative Commons.







